
Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
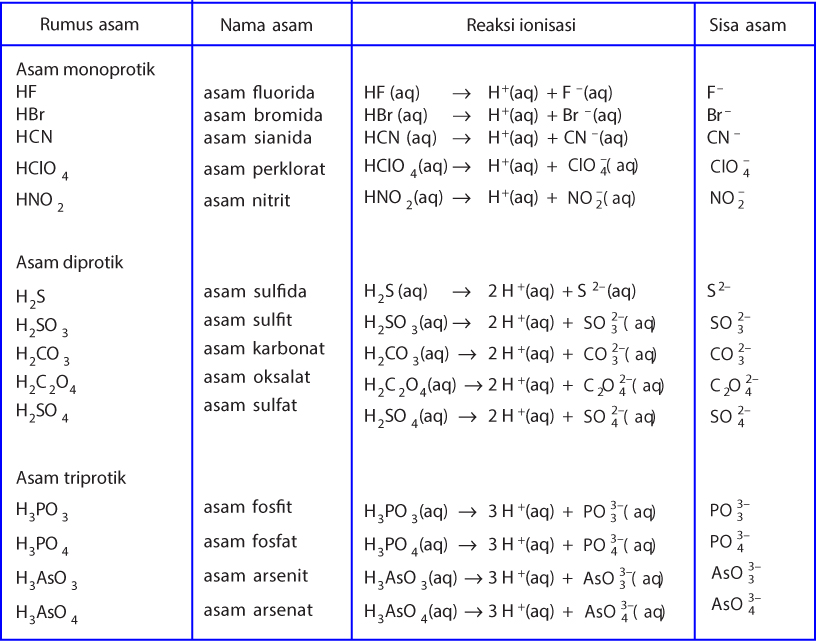
Ingat ya, ion H+ lho, guys! Asam dirumuskan sebagai HxZ dalam air dan akan mengalami ionisasi sebagai berikut: HxZ → xH+ + Zx. Nah, salah satu contoh zat yang termasuk larutan asam adalah asam sulfat atau H2SO4. Menurut Arrhenius, asam sulfat mempunyai sifat asam karena dapat melepaskan ion H+ dalam air. Sehingga nantinya konsentrasi H+ dalam.
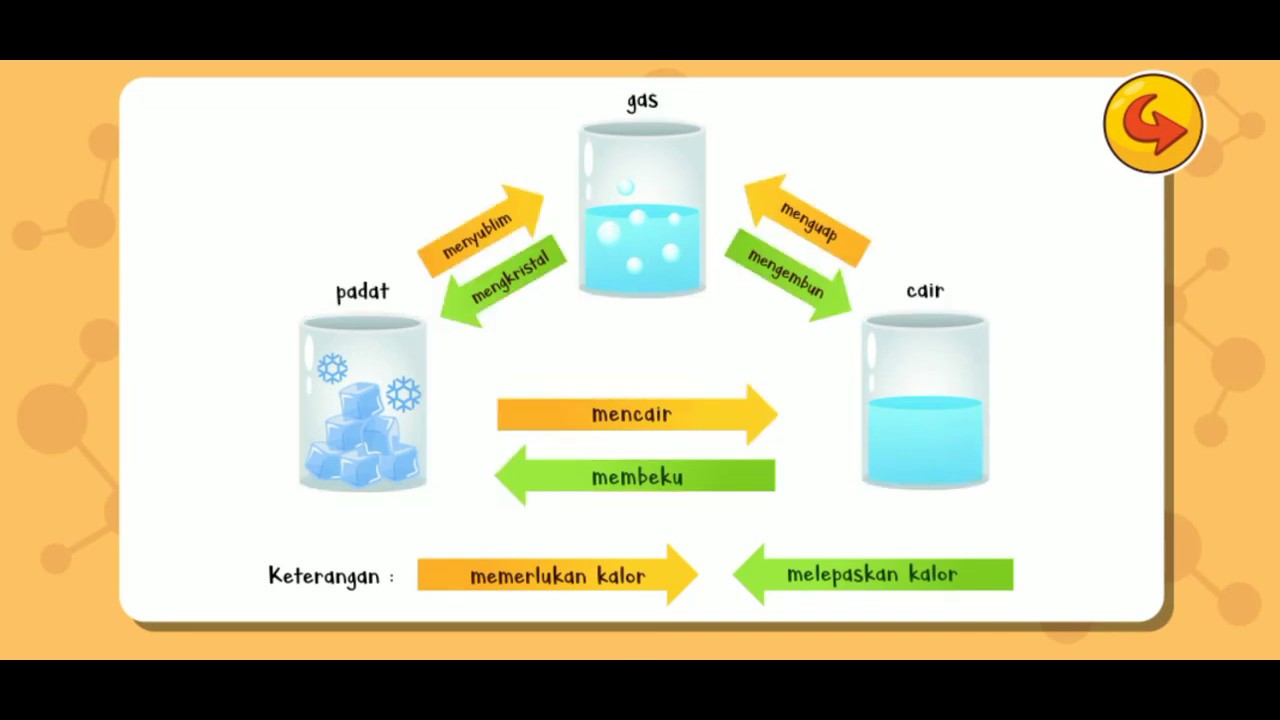
Perubahan Wujud Benda Tema 7 Kelas 5 Pigura
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Gambar Tahapan Siklus Air
Asam kuat merupakan asam yang jika dilarutkan dalam air mudah melepaskan ion H+, larutan tersebut akan mengalami disosiasi total dalam larutan. Contoh asam kuat yaitu HCl, HNO3, H 2 SO4, dan HClO4. Sementara basa kuat adalah senyawa basa yang jika dilarutkan dalam air mudah melepaskan ion OH-, larutan basa ini juga akan mengalami disosiasi total.
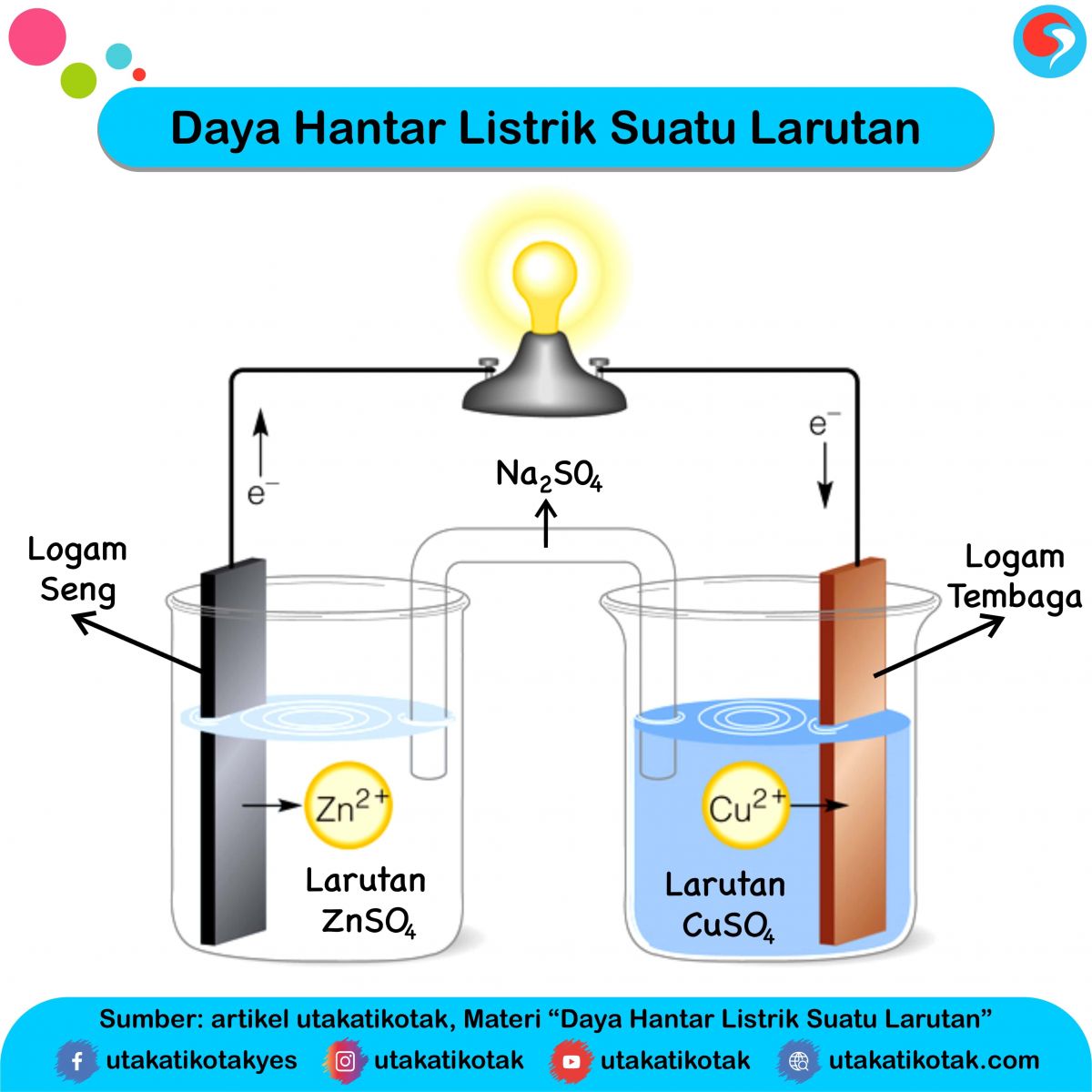
Air Gula Dapat Disebut Larutan Karena / Zat penyusun tercampur sempurna sehingga tidak dapat
Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H+, sedangkan basa adalah zat yang dalam air melepaskan ion OH-. Jadi pembawa sifat asam adalah ion H+, sedangkan pembawa sifat basa adalah ion OH-. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut. Jumlah ion H+, yang dapat dihasilkan oleh 1.

Di antara zat berikut berikatan ion, sehingga bila zat tersebut dilarutkan dalam air dapat
Asam kuat adalah asam yang ketika dilarutkan di dalam air bisa melepaskan ion H + dengan mudah. Larutan tersebut bisa mengalami disosiasi total dalam larutan. Sementara basa kuat adalah senyawa basa yang bila dilarutkan dalam air akan melepaskan ion OH - dengan mudah. Sementara itu, asam kuat + basa kuat = netral.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida. Garam

Fathul I'lmi Perpindahan Panas
Cara Membedakan Asam dan Basa. Senyawa asam dapat dengan mudah ditemukan pada buah-buahan, seperti jeruk dan lemon. Selain itu, bisa juga ditemukan pada bahan makanan, seperti cuka. Bahkan, senyawa asam juga banyak digunakan sebagai bahan pengawet makanan lho, misalnya asam benzoat yang dimanfaatkan sebagai pengawet jus buah dan selai.
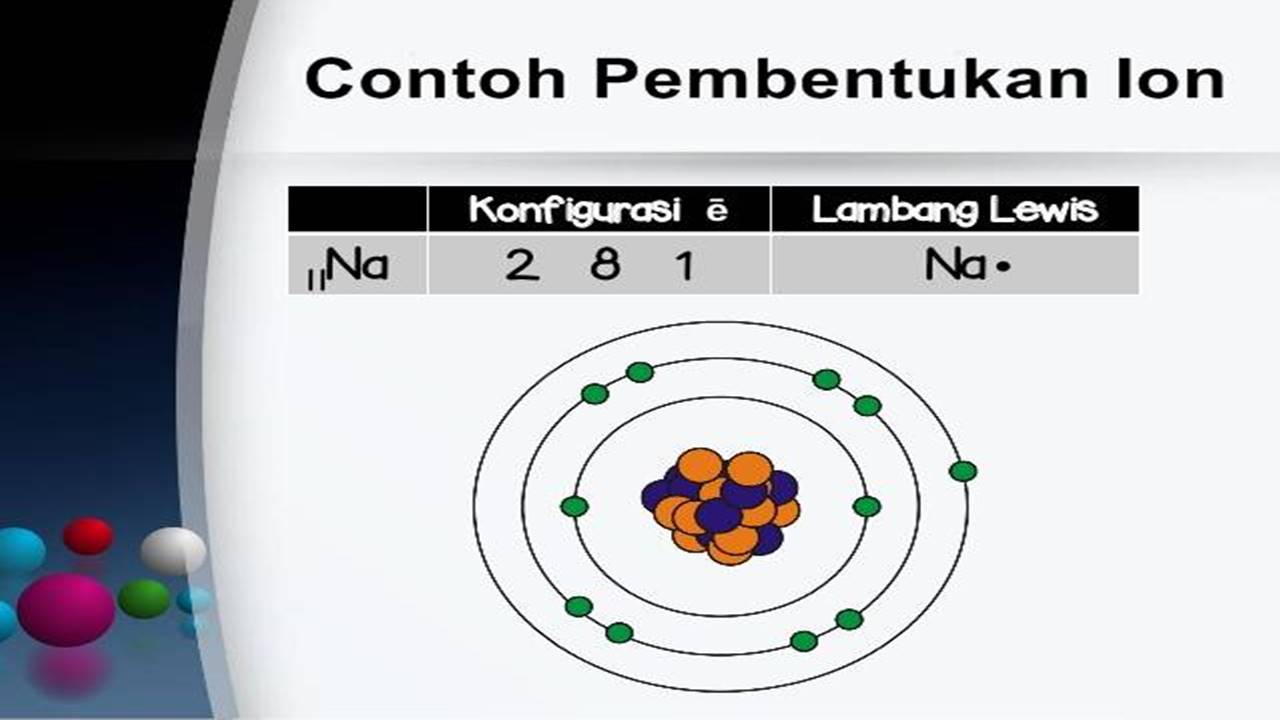
Pembentukan Ion
Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam larutan. Asam dan basa dapat bereaksi menghasilkan air dan senyawa ionic garam, reaksi tersebut disebut dengan reaksi netralisasi. Misalnya reaksi asam sulfat (H2SO4.

Teori Asam Basa
Ketika suatu zat dimasukkan ke dalam air, lalu dia melepaskan ion H+ maka disebut sebagai zat asam. Sementara jika dia melepaskan ion OH- maka disebut zat basa. Kekuatan elektrolit kedua larutan ini ditentukan oleh banyaknya ion yang dihasilkan. Prinsipnya, makin banyak ion yang dihasilkan, maka semakin kuat sifat elektrolitnya. Larutan jenis.

Asam adalah zat yang dalam air akan melepaskan ion H+ · PDF fileAsam adalah zat yang dalam
Secara kimia, asam dapat juga diartikan sebagai zat elektrolit yang apabila dilarutkan dalam air akan menghasilkan ion hidrogen (H+). Sementara itu, basa adalah zat elektrolit yang dapat menghasilkan ion hidroksida (OH-) di dalam air. Asam dan basa ini banyak kita jumpai dalam kehidupan sehari-hari.

3 contoh senyawa ion kovalen dan logam Alexandra Springer
Basa dalam larutan natrium hidroksida serta amonium hidroksida akan menghasilkan banyak ion OH- dan kemudian dapat disebut sebagai basa kuat.. bahwa senyawa asam merupakan senyawa yang dapat melepaskan ion H+ atau ion hydronium H3O+ apabila dilarutkan dalam air. Sedangkan senyawa basa adalah senyawa yang melepaskan ion OH- jika dilarutkan.
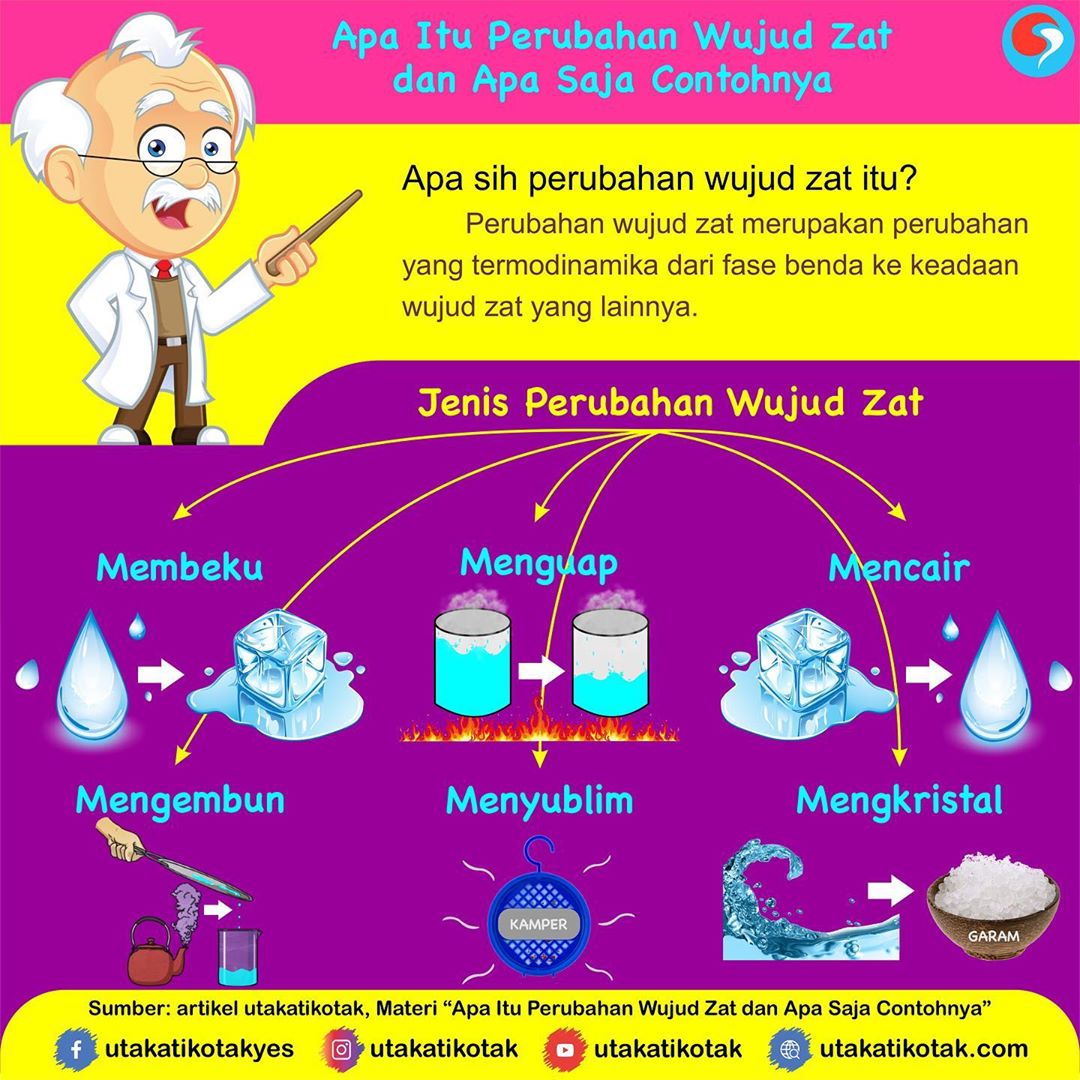
Contoh Perubahan Wujud Zat
Basa merupakan zat yang didalam air dapat melepaskan ion hidroksida (OH -) 2. Konsep Asam dan Basa Bronsted-Lowry. Perkembangan konsep asam dan basa berlanjut pada tahun 1923 ketika Johannes N. Bronsted dan Thomas M. Lowry menyatakan bahwa reaksi asam basa tidak hanya terbatas pada senyawa asam basa dalam pelarut air.
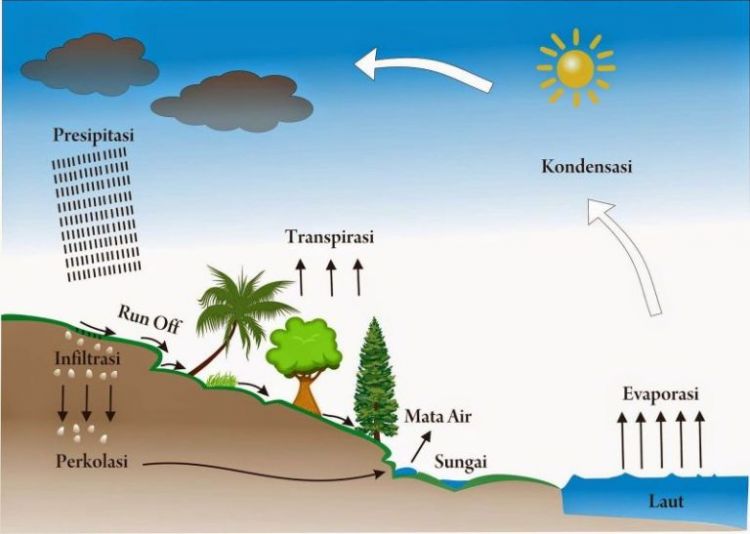
3 Siklus Terbentuknya Air Pengertian dan Jenis Jenisnya Lengkap Penjaskes.Co.Id
Beberapa zat dapat bertindak sebagai asam, namun juga dapat sebagai basa pada reaksi yang lain, misalnya H 2 O, HCO 3 −, dan H 2 PO 4 −.Zat demikian disebut amfiprotik. Suatu zat amfiprotik (misalnya H 2 O) akan bertindak sebagai asam bila direaksikan dengan zat yang lebih basa darinya (misalnya NH 3) dan bertindak sebagai basa bila direaksikan dengan zat yang lebih asam darinya (misalnya.

perbedaan senyawa ion dan senyawa kovalen Karen Welch
Pengertian Asam Basa. 1. Asam. Asam adalah senyawa kimia yang apabila dilarutkan didalam air, maka akan menghasilkan larutan dengan pH lebih kecil dari 7. Asam adalah sebuah zat yang bisa memberi proton (ion H+) terhadap zat lain (basa), atau bisa menerima pasangan elektron bebas dari sebuah basa.
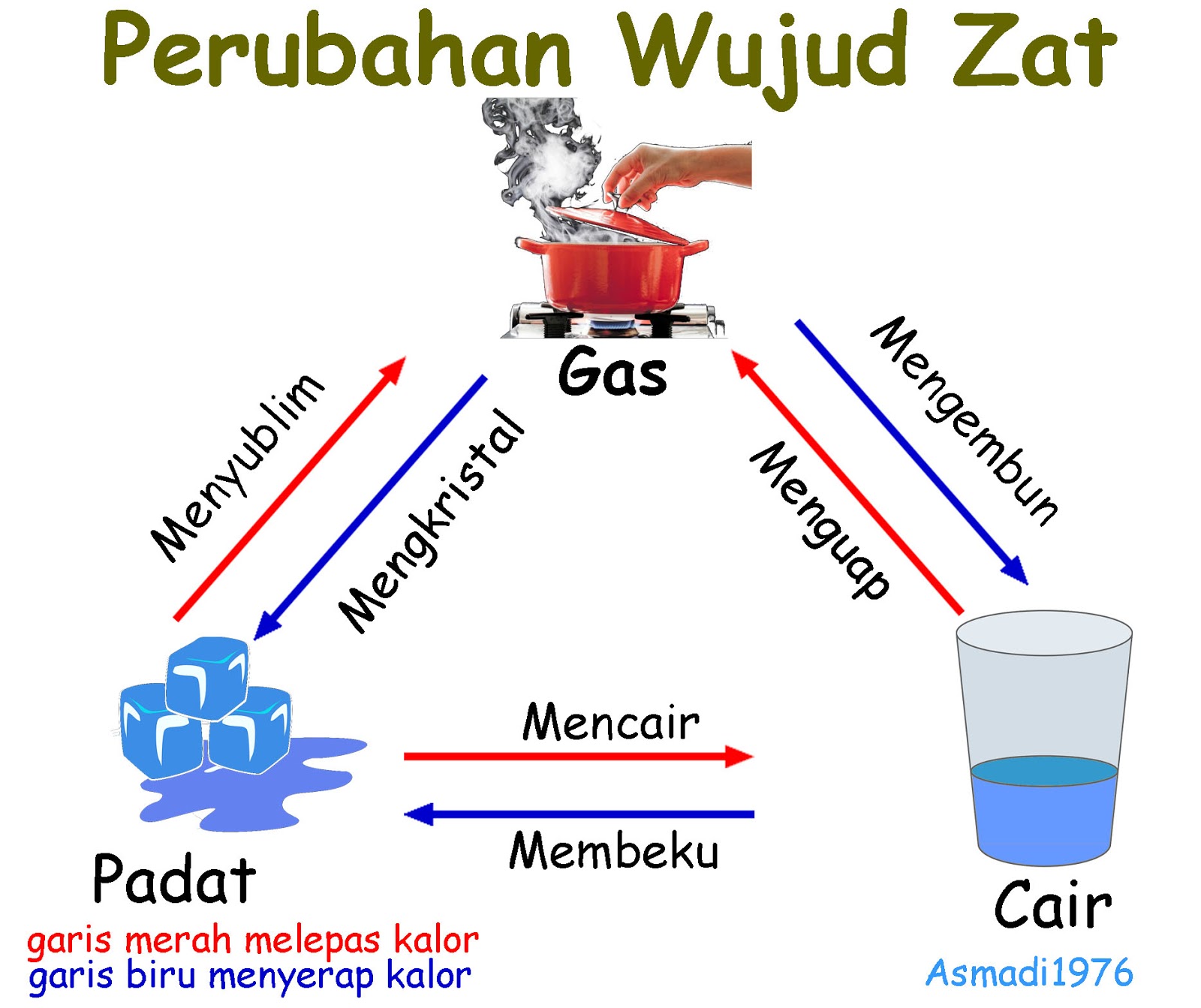
Wujud Zat Ada Berapa
Contohnya: Natrium hidroksida = NaOH → Na+ + OH-. Kalium hidroksida = KOH → K+ + OH-. Kalsium hidroksida = Ca (OH)2 → Ca2+ + 2OH-. Dan menurut teori arrhenius NH4OH merupakan senyawa basa karena dapat melepaskan ion OH- dalam larutannya. NH4OH akan terurai sesuai dengan persamaan reaksi berikut: NH4OH ⇌ NH4+ + OH-.

Perubahan Wujud Zat Padat Cair Dan Gas Beserta Contohnya Riset
Berbeda halnya dengan metana (CH4) yang bukan asam Arrhenius karena tidak dapat menghasilkan ion H+ dalam air meskipun memiliki atom H. Disamping itu, basa Arrhenius adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion OH -. Misalnya natrium hidroksida (NaOH) dan ammonium hidroksida (NH 4 OH).