Penurunan Tekanan Uap, Ini Pengertian dan Rumusnya!
Penerapan penurunan tekanan uap termasuk dalam berbagai aspek, seperti: 1. Pembentukan larutan: Ketika zat terlarut ditambahkan ke dalam pelarut, tekanan uap pelarut akan turun. 2. Penyegaran: Pada pembuatan es krim, penurunan tekanan uap larutan gula dan zat lainnya menyebabkan pendinginan larutan, membantu membekukan campuran tersebut. 3.

PENURUNAN TEKANAN UAP DAN KENAIKAN TITIK DIDIH YouTube
Contoh Soal Penurunan Tekanan Uap Larutan. 1. Tekanan uap air pada suhu 25 0C adalah 23,76 mmHg. Jika pada suhu yang sama, kedalam 900 mL air ditambahkan urea (Mr = 60 g/mol), tekanan uap larutan menjadi 22,84 mmHg. Penurunan tekanan uap larutan tersebut adalah…. Diketahui:

Animasi Sifat Koligatif Larutan Penurunan Tekanan Uap Free download cek deksripsi YouTube
Rumus penurunan tekanan uap jenuh dengan memakai faktor Van't Hoff hanya berlaku untuk fraksi mol zat terlarutnya saja (zat elektrolit yang mengalami ionisasi), sedangkan pelarut air tidak terionisasi. Oleh karena itu, rumus penurunan tekanan uap jenuh untuk zat elektrolit adalah:

Cara Menghitung Penurunan Tekanan Uap YouTube
Hubungan Penurunan Tekanan Uap dengan Bahan Bakar Kapal. Rumus penurunan tekanan uap adalah konsep penting dalam kimia, terutama ketika kita membahas sifat koligatif larutan. Sifat koligatif larutan mencakup penurunan tekanan uap, peningkatan titik didik, penurunan titik beku, dan tekanan osmotik. Dalam artikel ini, kita akan menjelajahi secara.

Soal Kimia Sifat Koligatif Penurunan Tekanan Uap Jenuh Read Master
Rumus penurunan tekanan uap zat elektrolit. Jika zat terlarut membentuk larutan bersifat asam, basa atau garam ternyata rumus penurunan tekanan uap memiliki nilai tidak sama atau lebih besar dari harga yang dihitung menurut perhitungan ideal. Rumus penurunan tekanan uap jenuh zat elektrolit sebagai berikut: ΔP = x B P o {1 + (n - 1) α.

penurunan tekanan uap, sifat koligatif, UN kimia 2016 pembahasan 027 YouTube
Latihan Soal Penurunan Tekanan Uap (Sedang) Pertanyaan ke 1 dari 5. 1. Pertanyaan. 18,625 gram garam KCl KCl dilarutkan dalam 750 mL air. Tentukan penurunan tekanan uap (ΔP) ( Δ P), bila tekanan uap jenuh air adalah 31,82 mmHg. ( Ar A r K = 39 K = 39; Cl Cl =35,5) 1. 0, 191 mmHg 0, 191 mmHg.

Proses Terjadinya Penurunan Tekanan Uap Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun
Pembahasan Tekanan Osmotik dari Pengertian hingga Contoh Soalnya. by Wilman Juniardi & Andjar Tyassih, S.Si. Januari 29, 2023. Jika sebelumnya kita sudah membahas materi penurunan tekanan uap dari sifat koligatif, maka artikel kali ini akan menjelaskan materi tekanan osmotik. Tekanan osmatik adalah adalah tekanan yang diperlukan untuk.

Soal Kimia Sifat Koligatif Penurunan Tekanan Uap Jenuh Read Master
Masukkan konstanta-konstanta Anda. Persamaan Clausius-Clapeyron memiliki dua konstanta: R dan ΔH uap.R selalu sama dengan 8,314 J/(K × Mol). Akan tetapi, ΔH uap (entalpi penguapan) bergantung pada zat yang tekanan uapnya Anda cari. Seperti yang dituliskan di atas, Anda biasanya dapat mencari nilai-nilai ΔH uap untuk berbagai macam zat di bagian belakang buku paket kimia atau fisika, atau.

Rumus Tekanan Uap Kimia Bit CDN
Tekanan yang ditimbulkan oleh uap jenuh air ini disebut tekanan uap jenuh air dan persamaannya disebut dengan rumus penurunan tekanan uap jenuh air. Dapat digambarkan melalui ilustrasi berikut: Besarnya tekanan uap jenuh untuk setiap zat tidak sama, bergantung pada jenis zat dan suhu. Zat yang lebih sukar menguap, misalnya glukosa, garam.

Sifat Koligatif 12 SMA (Penurunan tekanan uap) YouTube
Pengertian Penurunan Tekanan Uap, Rumus, dan Contoh Perhitungannya. by Wilman Juniardi & Andjar Tyassih, S.Si. Januari 29, 2023. Sudah masuk semester baru, saatnya belajar materi baru untuk Kimia di kelas 12. Materi yang akan kamu pelajari pertama kali adalah sifat koligatif larutan, salah satunya penurunan tekanan uap.

Pengertian Tekanan Satuan Dan Rumus Tekanan Beserta Contoh Soal Sexiz Pix
Besarnya penurunan tekanan uap jenuh larutan sebanding (berbanding lurus) dengan fraksi mol zat terlarut (yaitu jumlah zat terlarut) dan suhu. Rumus penurunan tekanan uap jenuh larutan (Δp) adalah sebagai berikut: P ₀ = tekanan uap jenuh pelarut murni (dalam mmHg) Xt = fraksi mol zat terlarut. Dari rumus di atas dapat ditarik kesimpulan, yakni.
Contoh Soal Penurunan Tekanan Uap Homecare24
Simak materi video belajar Penurunan Tekanan Uap Kimia untuk Kelas 12 IPA secara lengkap yang disertai dengan animasi menarik. Saatnya buat pengalaman belajarmu makin seru dengan Ruangguru.. Rumus penurunan tekanan uap larutan non elektrolit. 14:17. Contoh soal penurunan tekanan uap larutan non elektrolit. 14:27.

Penurunan Tekanan Uap Sifat Koligatif Larutan YouTube
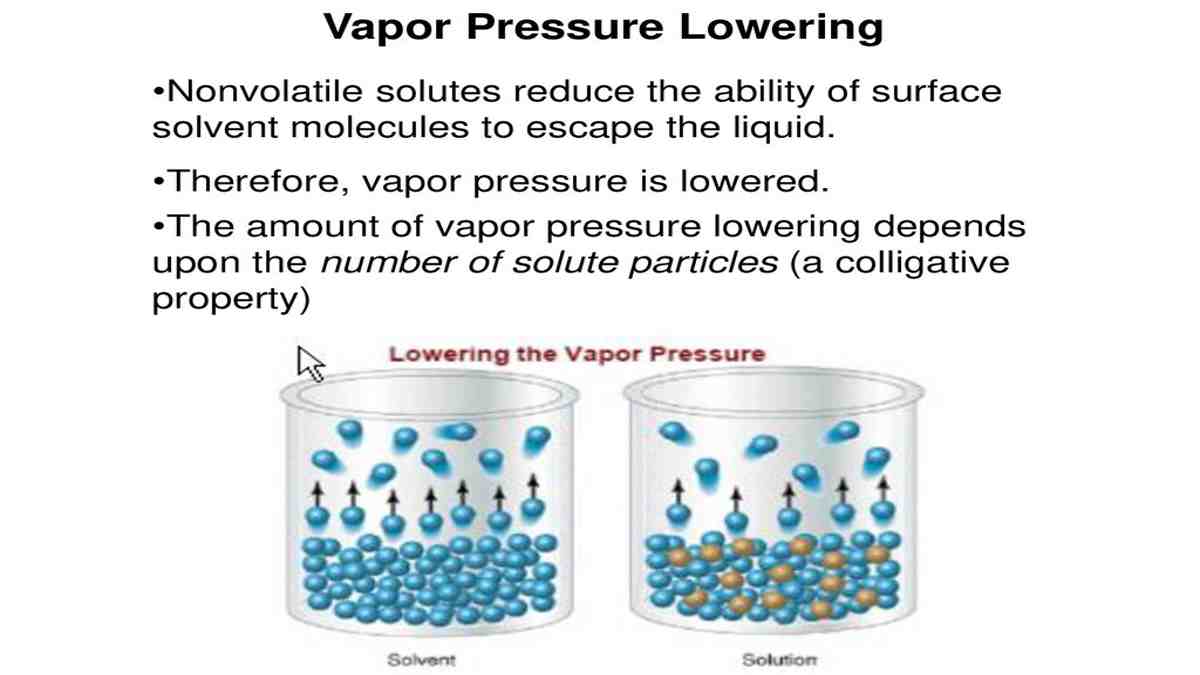
Kejadian itu akibat dari adanya proses penguapan dan penurunan tekanan uap. Untuk memahami fenomenanya, lebih baik kamu simak terlebih dahulu pengertian tekanan uap pada pelarut murni. Selain itu juga pelajari besarnya tekanan uap yang dipengaruhi oleh penambahan zat terlarut ke dalam pelarut murni. Simak terus! 1. Tekanan uap Pelarut Murni (Po.

Penurunan Tekanan Uap Beserta Rumus Dan Contoh Soalnya Materi Kimia My XXX Hot Girl
Penelitian tentang penurunan tekanan uap pertama kali dilakukan oleh ahli kimia asal Perancis, Francois Marie Raoult. Untuk memudahkannya dalam melakukan penelitian, Francois akhirnya membuat rumus penurunan tekanan uap. Saat ini, rumus penurunan tekanan uap kerap dipelajari dalam mata pelajaran kimia pada jenjang SMA.

Penurunan Tekanan Uap Larutan Pembahasan Soal YouTube
Teman-teman kelas 12, kita belajar tentang tekanan uap dan penurunan tekanan uap, yuk! Simak penjelasan dan lihat contoh soalnya, ya!. Penurunan Tekanan Uap Beserta Rumus dan Contoh Soalnya - Materi Kimia Kelas 12. Posted by by Eva Jessica; Agustus 4, 2022 0 Comments;

Video Penurunan Tekanan Uap Larutan YouTube
Penurunan tekanan uap (∆P) Tekanan uap adalah ukuran tendensi molekul-molekul cairan untuk melepaskan diri dari cairan di sekitarnya, dan berubah menjadi uap.. Berikut rumus persamaan untuk menentukan penurunan titik beku yang sebanding dengan hasil kali molalitas (m) dengan nilai penurunan titik beku molal (Kf). ΔTf = m x Kf.